ผลกระทบของภาวะน้ำตาลในเลือดสูงต่อโครงสร้างของผิวหนังชั้นหนังแท้ ในหนูที่ถูกเหนี่ยวนำให้เป็นเบาหวาน Effect of Hyperglycemia on Morphology of Dermal Skin in Diabetes-induced Rats
Main Article Content
Abstract
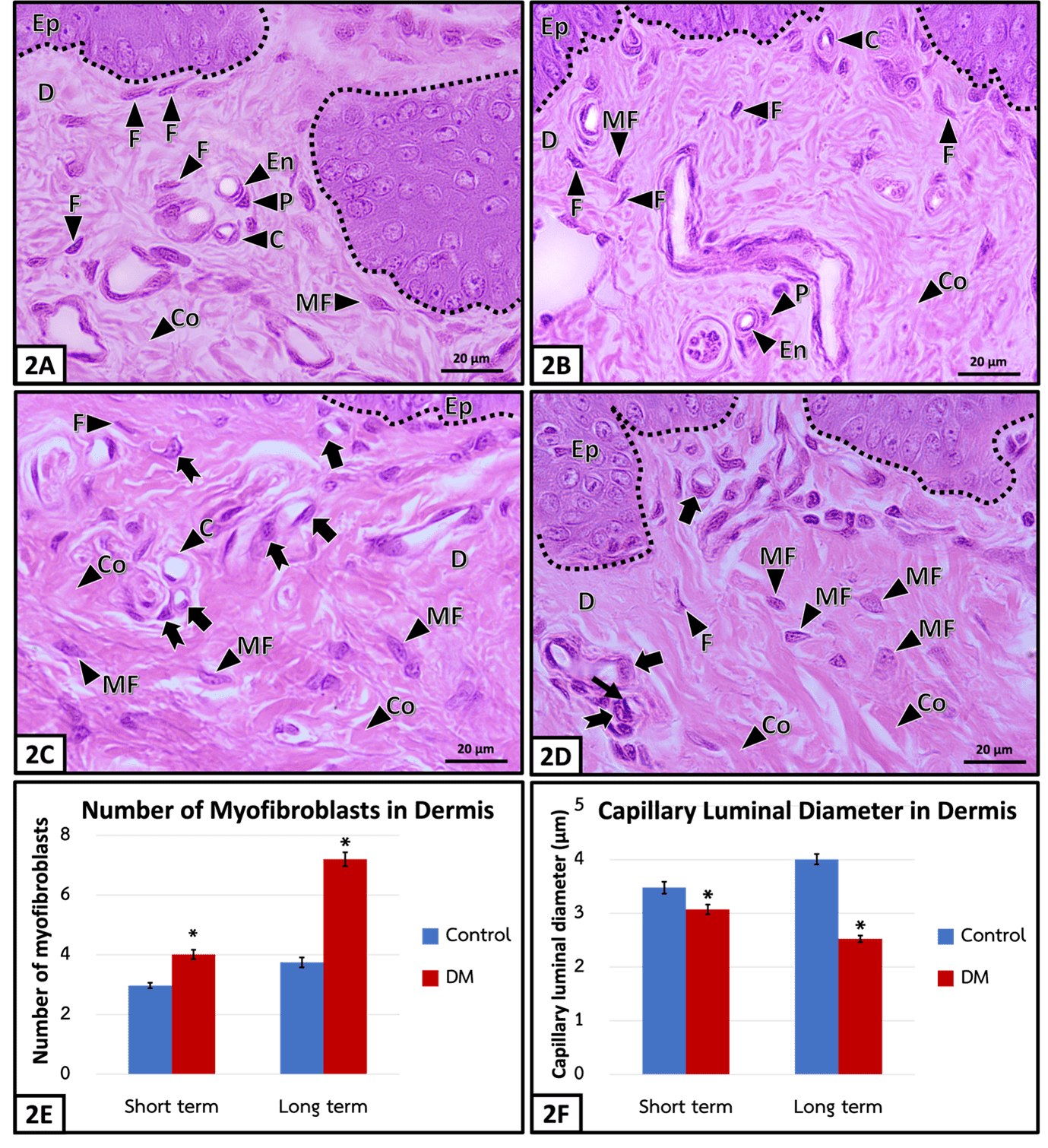
Diabetic skin is a condition of hyperglycemia-caused skin problem, which impairs wound healing, cutaneous infection, tissue necrosis and eventually causes amputation in diabetic patients. One of the important parts of the skin is the dermis, that functions to maintain homeostasis for the skin and provide complete wound healing processes. Therefore, the aim of this study was to clarify diabetic effects on dermal changes by the histomorphological and quantitative analyses in streptozotocin-induced type 1 diabetic rats, compared to aged-matched control rats, received citrate buffer at week 4 (short term) and week 24 (long term). In diabetes mellitus (DM), there was a significant increase in dermal thicknesses of forepaw skin in both terms: short-termed DM and long-termed DM, related to the presence of abundant myofibroblasts. The collagen content significantly increased in short-termed DM and long-termed DM, compared to control rats. Moreover, the capillaries in the dermo-epidermal junction showed the swelling of endothelial cells and pericytes and significantly reduced capillary luminal diameter in both terms of DM, compared to the rat control. During the long-termed DM, some of endothelial cell also underwent shrinkage with dense stained nucleus, indicating cell death.
บทคัดย่อ
โรคผิวหนังในภาวะเบาหวาน มีสาเหตุมาจากระดับน้ำตาลในเลือดสูง ก่อให้เกิดการเปลี่ยนแปลงของผิวหนัง ส่งผลให้แผลหายช้า ติดเชื้อที่ผิวหนัง และเกิดการตายของเนื้อเยื่อ จนนำไปสู่การสูญเสียอวัยวะส่วนปลายโดยเฉพาะบริเวณแขนและขา องค์ประกอบที่สำคัญอย่างหนึ่งของผิวหนังคือชั้นหนังแท้ ซึ่งทำหน้าที่ช่วยรักษาสภาวะสมดุลของผิวหนังและจำเป็นสำหรับการรักษาบาดแผลอย่างสมบูรณ์ การศึกษาครั้งนี้จึงมีวัตถุประสงค์เพื่อศึกษาการเปลี่ยนแปลงลักษณะทางจุลกายวิภาคและเชิงปริมาณของโครงสร้างชั้นหนังแท้ในหนูที่ถูกเหนี่ยวนำให้เกิดเบาหวานชนิดที่ 1 ด้วยสาร streptozotocin เปรียบเทียบกับกลุ่มควบคุมที่ได้รับสารละลายซิเตรตบัฟเฟอร์ (citrate buffer) ในระยะเวลา 4 สัปดาห์ (ระยะเริ่มต้น) และ 24 สัปดาห์ (ระยะเรื้อรัง) โดยพบว่าความหนาของชั้นหนังแท้จากผิวหนังบริเวณใต้ฝ่าเท้าด้านหน้าเพิ่มขึ้นอย่างมีนัยสำคัญทางสถิติทั้งกลุ่มเบาหวานระยะเริ่มต้นและระยะเรื้อรัง ร่วมกับการพบจำนวนเซลล์ไมโอไฟโบรบลาสต์ (myofibroblasts) และเส้นใยคอลลาเจน (collagen) ในชั้นหนังแท้ของหนูเบาหวานทั้งสองระยะ มีการเพิ่มขึ้นอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มควบคุม อีกทั้งยังพบว่าภาวะเบาหวานทั้งสองระยะส่งผลให้เกิดการบวมของเซลล์ (cell) บุผนังหลอดเลือดและเพอริไซต์ (pericyte) ส่วนท่อภายในหลอดเลือดฝอยตีบแคบลงอย่างมีนัยสำคัญทางสถิติเมื่อเทียบกับกลุ่มควบคุม นอกจากนี้ภาวะเบาหวานระยะเรื้อรังยังส่งผลให้เซลล์บุผนังหลอดเลือด มีนิวเคลียสติดสีเข้มขึ้น ซึ่งบ่งชี้ถึงการตายของเซลล์
Downloads
Article Details
References
Chen, X.F., W.D. Lin, S.L. Lu, T. Xie, K. Ge, Y.Q. Shi, J.J. Zou, Z.M. Liu and W.Q. Liao. (2010). Mechanistic study of endogenous skin lesions in diabetic rats. Experimental Dermatology, 19(12), 1088-1095. doi: 10.1111/j.1600-0625.2010.01137.x.
Dagher, Z., Y.S. Park, V. Asnaghi, T. Hoehn, C. Gerhardinger and M. Lorenzi. (2004). Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes, 53(9), 2404-2411. doi: 10.2337/diabetes.53.9.
De Macedo, G.M. C., S. Nunes and T. Barreto. (2016). Skin disorders in diabetes mellitus: an epidemiology and physiopathology review. Diabetology & Metabolic Syndrome, 8(1), 1-8. doi: 10.1186/s13098-016-0176-y.
De Waard, G.A., H. R. Hollander, D. Ruiter, T. ten Bokkel Huinink, R. Meer, N. W. van der Hoeven, E. Meinster, J. A. Beliën, H. W. Niessen
and N. van Royen. (2020). Downstream influence of coronary stenoses on microcirculatory remodeling: a histopathology study. Arteriosclerosis, Thrombosis, and Vascular Biology, 40(1), 230-238. doi: 10.1161/ATVBAHA.119.313462.
Demirseren, D.D., S. Emre, G. Akoglu, D. Arpacı, A. Arman, A. Metin and B. Cakir. (2014). Relationship between skin diseases and extracutaneous complications of diabetes mellitus: clinical analysis of 750 patients. American Journal of Clinical Dermatology, 15(1), 65-70. doi: 10.1007/s40257-013-0048-2.
Gkogkolou, P. and M. Böhm. (2014). Skin disorders in diabetes mellitus. Journal der Deutschen Dermatologischen Gesellschaft, 12 (10), 847-864. doi: 10.1111/ddg.12424.
Kumar, S., V. Kain and S.L. Sitasawad. (2012). High glucose-induced Ca2+ overload and oxidative stress contribute to apoptosis of cardiac cells through mitochondrial-dependent and independent pathways. Biochimica et Biophysica Acta (BBA) - General Subjects, 1820(7): 907-920. doi: 10.1016/j.bbagen.2012.02.010.
Lennertz, R.C., K.A. Medler, J.L. Bain, D.E. Wright and C.L. Stucky. (2011). Impaired sensory nerve function and axon morphology in mice with diabetic neuropathy. Journal of Neurophysiol. 106(2): 905-914.
Linn, G.R., H. Ling, K.D. Wu, T.J. Tsai, Y.M. Chen, J.S. Duffield and S. L. Lin. (2012). Transforming growth factor β-1 stimulates profibrotic epithelial signaling to activate pericyte-myofibroblast transition in obstructive kidney fibrosis. The American Journal of Pathology, 182(1), 118-131. doi: 10.1152/jn.01123.2010.
Lorenzi, M. (2007). The polyol pathway as a mechanism for diabetic retinopathy: attractive, elusive, and resilient. Journal of Diabetes Research, 2007, 1-10. doi: 10.1155/2007/61038
Makrantonaki, E., D. Jiang, A.M. Hossini, G. Nikolakis, M. Wlaschek, K. Scharffetter-Kochanek and C.C. Zouboulis. (2016). Diabetes mellitus and the skin. Reviews in Endocrine and Metabolic Disorders, 17(3), 269-282. doi: 10.1007/s11154-016-9373-0.
Merecz-Sadowska, A., P. Sitarek, E. Kucharska, T. Kowalczyk, K. Zajdel, T. Cegliński and R. Zajdel. (2021). Antioxidant properties of plant-derived phenolic compounds and their effect on skin fibroblast cells. Antioxidants, 10(5), 726. doi: 10.3390/antiox10050726.
Minchenko, A.G., M.J. Stevens, L. White, O.I. Abatan, K. Komjáti, P. Pachter, C. Szabó and I.G. Obrosova. (2003). Diabetes‐induced overexpression of endothelin‐1 and endothelin receptors in the rat renal cortex is mediated via poly (ADP‐ribose) polymerase activation. The FASEB Journal, 17(11), 1-8. doi: 10.1096/fj.03-0013fje.
Soriano, F., L. Virág and C. Szabó. (2001). Diabetic endothelial dysfunction: role of reactive oxygen and nitrogen species production and
poly (ADP-ribose) polymerase activation. Journal of Molecular Medicine, 79, 437-448. doi: 10.1007/s001090100236.
Techarang, T., P. Lanlua, A. Niyomchan, K. Plaengrit, A. Chookliang and S. Sricharoenvej. (2017). Epidermal modification in skin of streptozotocin-induced diabetic rats. Walailak Journal of Science and Technology, 14(8), 671-676.
Tellechea, A., A. Kafanas, E.C. Leal, F. Tecilazich, S. Kuchibhotla, M.E. Auster, I. Kontoes, J Paolino, E. Carvalho, L.P. Nabzdyk and A. Veves. (2013). Increased skin inflammation and blood vessel density in human and experimental diabetes. The International Journal of Lower Extremity Wounds, 12(1), 4-11. doi: 10.1177/1534734612474303.
Tortora, G.J. and B.H. Derrickson. (2018). Principles of anatomy and physiology (15 Ed). New Jersey: John Wiley and Sons.
Tuleta. I. and N.G. Frangogiannis. (2021). Diabetic fibrosis. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 1867(4) 1-20. doi: 10.1016/j.bbadis.2020.166044.
Wang, Y.N., K. Lee and W.R. Ledoux. (2011). Histomorphological evaluation of diabetic and non-diabetic plantar soft tissue. Foot & Ankle International, 32(8), 802-810. doi: 10.3113/FAI.2011.0802.
Wu, M.Y., G.T. Yiang, T.T. Lai and C. J. Li. (2018). The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxidtive Medicine and Cellular Longevity, 2018, 1-12. doi 10.1155/2018/3420187.
Xue, M., R. Zhao, L. March and C. Jackson. (2022). Dermal fibroblast heterogeneity and its contribution to the skin repair and regeneration. Advances in Wound Care, 11(2), 87-107. doi: 10.1089/wound.2020.1287.
Yagihashi, S., H. Mizukami and K. Sugimoto. (2011). Mechanism of diabetic neuropathy: where are we now and where to go?. Journal of Diabetes Investigation, 2(1): 18-32. doi: 10.1111/j.2040-1124.2010.00070.x.