พฤกษเคมีและการยับยั้งเอนไซม์แอลฟากลูโคซิเดสของต้นอ่อน 5 ชนิด | Phytochemicals and α-Glucosidase Inhibition of 5 Sprout Species
Main Article Content
Abstract
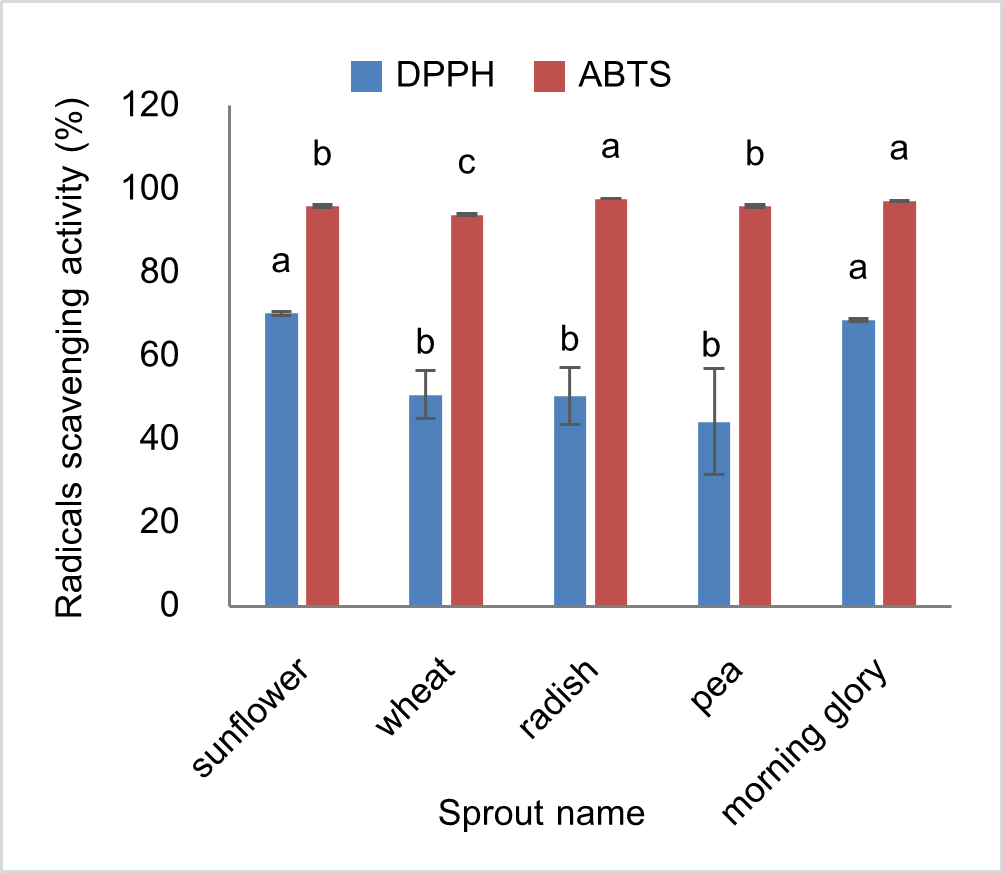
Using natural substances instead of chemical drugs is a new alternative for diabetes treatment. The objective of this study was to investigate the phytochemicals including chlorophyll, phenolic compounds, flavonoids, total sugar, protein, and antioxidant activity as well as in vitro α-glucosidase inhibitory activity of 5 sprout species namely sunflower, wheatgrass, radish, pea, and morning glory. The result was that wheatgrass showed the content of chlorophyll a (0.03 mg/g FW), chlorophyll b (0.02 mg/g FW), total chlorophyll (0.05 mg/g FW), phenolic compounds (81.30 mg GAE/g FW) and flavonoids (391.92 mg QE/g FW) higher than other species. Total sugar (14.52–15.03 mg/g FW) and protein (0.018–0.022 %) contents as well as antioxidant activity by DPPH (44.22–70.24%) and ABTS assay (93.92–97.68%) of 5 sprouts were a little different. All of them could inhibit α-glucosidase activity with more than 50%. Radish sprouts showed the highest inhibitory activity of α-glucosidase (306.94%). These results suggested that radish sprouts had a potential to be used as a functional food and nutraceutical for diabetes therapy.
บทคัดย่อ
การใช้สารจากธรรมชาติทดแทนสารเคมีเป็นทางเลือกใหม่ในการบำบัดโรคเบาหวาน งานวิจัยนี้จึงมีวัตถุประสงค์เพื่อศึกษาปริมาณสารพฤกษเคมี ได้แก่ คลอโรฟิลล์ สารประกอบฟีนอล ฟลาโวนอยด์ น้ำตาลทั้งหมด โปรตีน และฤทธิ์ต้านอนุมูลอิสระ รวมถึงฤทธิ์ยับยั้งกิจกรรมของเอนไซม์แอลฟากลูโคซิเดสของต้นอ่อน 5 ชนิด ได้แก่ ทานตะวัน ข้าวสาลี ไควาเระ โต้วเหมี่ยว และผักบุ้ง ผลการทดลองพบว่าข้าวสาลีมีปริมาณคลอโรฟิลล์ เอ (0.03 มก./ก. น้ำหนักสด) คลอโรฟิลล์ บี (0.02 มก./ก. น้ำหนักสด) คลอโรฟิลล์รวม (0.05 มก./ก. น้ำหนักสด) สารประกอบฟีนอล (81.30 มก. สมมูลของกรดแกลลิค/ก. น้ำหนักสด) และฟลาโวนอยด์ (391.92 มก. สมมูลของเควอซิติน/ก. น้ำหนักสด) สูงกว่าต้นอ่อนชนิดอื่น ต้นอ่อนทั้ง 5 ชนิดมีปริมาณน้ำตาล (14.52–15.04 มก./ก. น้ำหนักสด) โปรตีน (0.018–0.022 %) และฤทธิ์ต้านอนุมูลอิสระ โดยวิธี DPPH (44.22–70.24%) และวิธี ABTS (93.92–97.68%) ใกล้เคียงกัน และมีฤทธิ์ยับยั้งเอนไซม์แอลฟากลูโคซิเดสมากกว่า 50% โดยต้นอ่อนไควาเระมีฤทธิ์ในการยับยั้งเอนไซม์แอลฟากลูโคซิเดสสูงที่สุด (306.94%) จากผลที่ได้ชี้ให้เห็นว่าต้นอ่อนไควาเระมีศักยภาพในการนำมาใช้เป็นอาหารเพื่อสุขภาพและโภชนเภสัชในการบำบัดโรคเบาหวานได้ดีที่สุด
Downloads
Article Details
References
Barnes, J. D., Balaguer, L., Manrique, E., Elvira, S., & Davision, A. W. (1992).
A reappraisal of the use of DMSO for the extraction and determination of chlorophyll a and chlorophyll b in lichens and higher plants. Environmental and Experimental Botany, 32(2), 85–100.
Bradford, M. M. (1976). A rapid and sensitive for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72, 248–254.
Brand-Williams, W., Cuvelier, M. E., & Berset, C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT Food Science and Technology, 28(1), 25–30.
Deutschlander, M. S., Venter van de, M., Roux, S., Louw, J., & Lall, N. (2009). Hypoglycemic activity of four plant extracts traditionally used in South Africa for diabetes. Journal of Ethnopharmacology, 124(3), 619–624.
Dubois, M., Gilles, K. A., Hamilton, J. K., Rebers, P. A., & Smith, F. (1956). Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 28(3), 350–356.
Gerich, J. E., Meyer, C., Woerle, H. J., & Stumvoll,M.(2001). Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes Care,24(2),382–391.
Guariguata, L., Whiting, D. R., Hambleton, I., Beagley, J., Linnenkamp, U., & Shaw, J. E. (2014). Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Research Clinical Practice, 103(2), 137–149.
Hajare, S. N., Saroj, S. D., Dhokane, V. S., Shasidhar, R., & Banddekar, J. R. (2007). Effect of radiation processing on nutritional and sensory quality of minimally processed green gum and garden pea sprouts. Radiation Physics and Chemistry,76, 1642–1649.
Hemalatha, P., Bomzan, D. P., Rao, B. V. S., & Sreerama, Y. N. (2016). Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects on α-amylase and α-glucosidase activities. Food Chemistry, 199,330–338.
Kazeem, M. I., Adamson, J. O., & Ogunwande I. A., (2013). Modes of inhibition of α-amylase and α-glucosidase by aqueous extract of Morinda lucida Benth leaf. BioMed Research International,2013, 1–6.
Lordan, S., Smyth, T. J., Soler-Vila, A., Stanton, C., & Ross, R. P., (2013). The α-amylase and α-glucosidase inhibitory effects of Irish seaweed extracts. Food Chemistry, 141(3),2170–2176.
Oswald, J., & Oswald, D. (2002). Sprout for survival. Plant Base Nutrition, 5, 1-16.
Padalia, S., Drabu, S., Raheja, I., Gupta, A., & Dhamija, M. (2010). Multitude potential
of wheatgrass juice (Green Blood): An overview. Chronicles of Young Scientists,2, 23–28.
Pajak, P., Socha, R., Galkowska, D., Roznowsk, J., & Fortuna, T. (2014). Phenolic profile and antioxidant activity in selected seeds and sprouts. Food Chemistry,143, 300–306.
Pantidos, N., Boath, A., Lund, V., Conner, S., & McDougall, G. J. (2014). Phenolic-rich extracts from the edible seaweed, Ascophyllum nodosum, inhibit α-amylase and α-glucosidase: potential anti-hyperglycemic effects. Journal of Functional Foods,10, 201–209.
R Core Team. (2015), R: A Language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Retrieved March,15 2015, from http://www.R-project.org/.
Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M., & Rice-Evans, C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 26, 1231–1237.
Sangronis, E., & Machado, C. J. (2007). Influence of germination on the nutritional quality of Phaseolus vulgaris and Cajanus cajan. LWT-Food Science and Technology,40, 116–120.
Singleton, V. L., Orthofer, R., & Lamuela-Ravenros, R. M. (1999). Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. Methods in Enzymology,299, 152–178.
Tunna, T. S., Zaidul, I. S. M., Ahmed, Q. U., Ghafoor, K., Al-Juhaimi, F. Y., Addin, M. S., Hasan, M., & Ferdous, S. (2015). Analyses and profiling of extract and fractions of neglected weed Mimosa pudica Linn. Traditionally used in Southeast Asia to treat diabetes. South African Journal of Botany, 99, 144–152.
Winkelman, M. (1989). Ethnobotanical treatments of diabetes in Baja California Norte. Medical Anthropology, 11(3), 255–268.
World Health Organization. (2015). Guideline: sugars intake for adults and children. Geneva, World Health Organization Editors.