กิจกรรมการต้านจุลินทรีย์ของเอนโดไฟติกแอคติโนแบคทีเรียที่แยก จากรากพืชป่าชายเลน | Antimicrobial Activity of Endophytic Actinobacteria Isolated from Root of Mangrove Plants
Main Article Content
Abstract
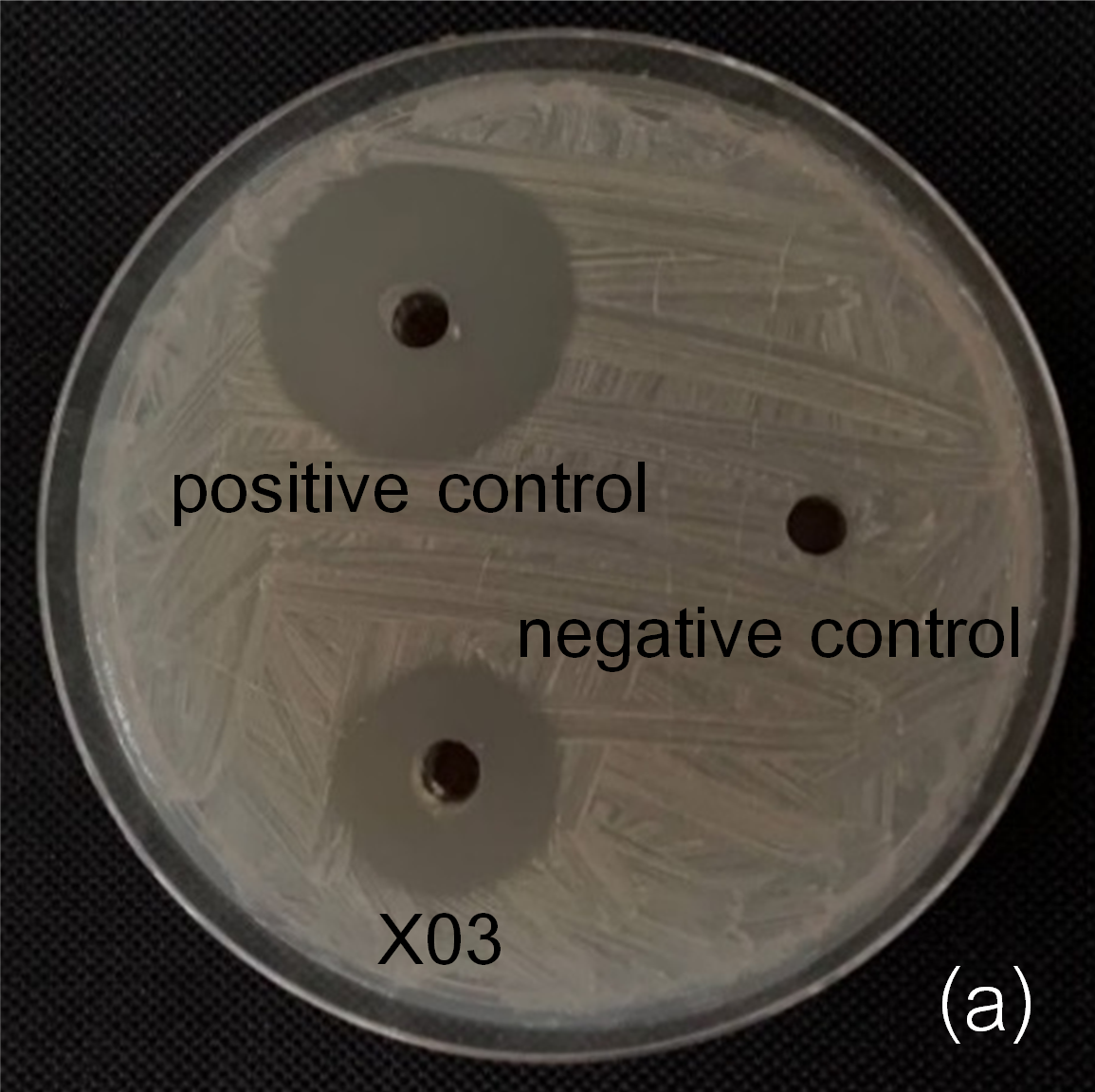
Nowadays, pathogenic microorganisms tend to become increasingly resistant to antibiotics. Therefore, it is necessary to find new bioactive compounds. Actinobacteria are Gram-positive bacteria that can produce secondary metabolite with diverse biological activities. This study was carried out to evaluate the antagonistic activity of actinobacteria isolated from mangrove plants against Bacillus cereus, Escherichia coli, Pseudomonas aeruginosa and Staphylococcus aureus. Total of 18 endophytic actinobacteria were isolated from roots of 7 different mangrove plant species, consisting of Avicennia marina (2 isolates), Lummitzera littorea (4 isolates), Nypa fruticans (1 isolate), Rhizophora apiculata (3 isolates), Rhizophora mucronata (5 isolates), Sonneratia ovata (1 isolate) and Xylocarpus granatum (2 isolates). The antimicrobial activity of isolated actinobacteria against tested bacteria was performed using agar overlay method. The results showed that 8 isolates could inhibit at least one type of tested pathogenic bacteria. Isolates RA02, RA05 and X03 that exhibited potent antagonistic activity were tested for antimicrobial activity using the agar well diffusion assay. The cell-free supernatant of isolate X03 displayed effective antagonistic activity against B. cereus and S. aureus with inhibition zone diameter of 18.5 and 20.0 mm., respectively. Based on partial 16S rDNA analysis, the isolate X03 was identified to the genus Actinomadura sp., with 98.93 % similarity to A. atramentaria IFO 14695T (U49000). This study is the first published report of endophytic Actinomadura isolated from Xylocarpus granatum in Thailand. These results reveal the mangrove plants are an important source for the discovery of actinobacteria with biologically active compound.
บทคัดย่อ
ปัจจุบันจุลินทรีย์ที่ก่อให้เกิดโรคมีแนวโน้มดื้อต่อยาปฏิชีวนะเพิ่มมากขึ้น ดังนั้นจึงจำเป็นต้องค้นหาสารออกฤทธิ์ทางชีวภาพชนิดใหม่ แอคติโนแบคทีเรียเป็นแบคทีเรียแกรมบวกที่สามารถผลิตสาร
เมทาบอไลต์ทุติยภูมิที่มีคุณสมบัติเป็นสารออกฤทธิ์ทางชีวภาพได้หลากหลายชนิด งานวิจัยนี้ศึกษากิจกรรมการต้านจุลินทรีย์ของแอคติโนแบคทีเรียที่แยกจากพืชป่าชายเลนต่อการยับยั้ง Bacillus cereus, Escherichia coli, Pseudomonas aeruginosa และ Staphylococcus aureus แยกแอคติโนแบคทีเรียจำนวนทั้งสิ้น 18 ไอโซเลต จากรากพืชป่าชายเลน 7 ชนิด ประกอบด้วย แสมทะเล (2 ไอโซเลต) ฝาดแดง (4 ไอโซเลต) จาก (1 ไอโซเลต) โกงกางใบเล็ก (3 ไอโซเลต) โกงกางใบใหญ่ (5 ไอโซเลต) ลำแพน (1 ไอโซเลต) และตะบูนขาว (2 ไอโซเลต) นำแอคติโนแบคทีเรียที่แยกได้มาทดสอบกิจกรรมการยับยั้งแบคทีเรียด้วยวิธี agar overlay ผลการทดลองพบว่ามีจำนวน 8 ไอโซเลต สามารถยับยั้งการเจริญของแบคทีเรียก่อโรคที่ทดสอบได้อย่างน้อย 1 ชนิด ไอโซเลต RA02, RA05 และ X03 แสดงประสิทธิภาพในการเป็นปฏิปักษ์ดีที่สุด เมื่อนำมาทดสอบฤทธิ์การต้านจุลินทรีย์ด้วยวิธี agar well diffusion พบว่าน้ำเลี้ยงเชื้อปราศจากเซลล์ของไอโซเลต X03 สามารถยับยั้งการเจริญของ B. cereus และ S. aureus ดีที่สุด โดยมีความกว้างโซนยับยั้งเท่ากับ 18.5 และ 20.0 มิลลิเมตร ตามลำดับ เมื่อวิเคราะห์ลำดับนิวคลีโอไทด์บางส่วนของยีน 16S rDNA พบว่าไอโซเลต X03 จัดอยู่ในสกุล Actinomadura โดยมีเปอร์เซ็นต์ความเหมือน 98.93 % กับ A. atramentaria IFO 14695T (U49000) มากที่สุด งานวิจัยนี้เป็นรายงานครั้งแรกของ Actinomadura ซึ่งเป็นเอนโดไฟท์ที่ได้จากรากตะบูนขาวพืชป่าชายเลนในประเทศไทย จึงแสดงให้เห็นว่าพืชป่าชายเลนเป็นแหล่งสำคัญในการค้นหาแอคติโนแบคทีเรียที่ผลิตสารประกอบที่มีฤทธิ์ทางชีวภาพ
Downloads
Article Details
References
Azman, I., Othman A.S., Velu S.S., Chan K.G. & Lee L.H. (2015). Mangrove rare actinobacteria: taxonomy, natural compound, and discovery of bioactivity. Frontiers in Microbiology, 6, 856. doi: 10.3389/fmicb.2015.00856.
Berdy, J., Aszalos A. & McNitt K.L. (1987a). Handbook of antibiotic compounds, Volume XIII, Part 1 . Boca Raton: CRC Press.
Berdy, J., Aszalos A. & McNitt K.L. (1987b). Handbook of antibiotic compounds, Volume XIII, Part 2 . Boca Raton: CRC Press.
Berdy, J., Aszalos A. & McNitt K.L. (1987c). Handbook of antibiotic compounds, Volume XIII, Part 3. . Boca Raton: CRC Press.
Bonomo, R.A. & Szabo D. (2006). Mechanisms of multidrug resistance in Acinetobacter species and Pseudomonas aeruginosa [Issue Supplement]. Clinical Infectious Diseases, 43(2), S49–S56. doi: 10.1086/504477.
Bushell, M.E. (1993). A method for increasing the success rate of duplicating antibiotic activity in agar and liquid cultures of Streptomyces isolates in new antibiotics screens. Journal of Fermentation Bioengineering, 76(2),
89–93. doi: 10.106/0922-338X(93)90062-D.
Butler, M.S. (2004). The role of natural products chemistry in drug discovery. Journal of Natural Products, 67, 2141–2153. doi: 10.1021/np040106y.
Bycroft, B.W., Higton, A., & Roberts, A.D. (1988). Dictionary of antibiotics and related substances. London: Chapman and Hall.
Crumplin, G.C. & Smith J.T. (1975). Nalidixic acid: an antibacterial paradox. Antimicrobial agents and chemotherapy, 8(3), 251–261. doi: 10.1128/AAC.8.3.251.
Govindasamy, V. & Franco C.M.M. (2013). Endophytic actinobacteria: diversity and ecology. Advances in Endophytic Research. New Delhi, Springer.
Gurung, T.D., Sherpa C., Agrawal V.P. & Lekhak B. (2010). Isolation and characterization of antibacterial actinomycetes from soil samples of Kalapatthar, Mount Everest Region. Nepal Journal of Science and Technology, 10, 173–182. doi: 10.3126/njst.v10i0.2957.
Hedge, V., Patel M., Horan A., Gullo V., Marquez J., Gunnarsson I., Gentile F., Loebenber D., King A., Puar M. & Pramanik B. (1992). Macrolactams: a novel class of antifungal antibiotics produced by Actinomadura spp. SC1776 and SCC 1777. The Journal of Antibiotics, 45, 624–632. doi: 10.7164/antibiotics.45.624.
Herrick, E.J. & Hashmi M.F. (2022). Antifungal ergosterol synthesis inhibitors. Retrieved October 18, 2022, from https://www.ncbi.nlm.nih.gov/books/NBK551581/
Himaman, W., Thamchaipenet A., Pathom-aree W. & Duangmal K. (2016). Actinomycetes from Eucalyptus and their biological activities for controlling Eucalyptus leaf and shoot blight. Microbiological Research, 188–189, 42–52. doi: 10.1016/j.micres.2016.04.011.
Hong, K., Gao A.-H., Xie Q.-Y., Gao H., Zhuang L., Lin H.-P., Yu H.-P., Li J., Yao X.-S., Goodfellow M. & Ruan J.-S. (2009). Actinomycetes for marine drug discovery isolated from mangrove soils and plants in China. Marine Drugs, 7(1), 24–44. doi: 10.3390/md7010024.
Jiang, Z.K., Tuo L., Huang D.L., Osterman I.A., Tyurin A.P., Liu S.W., Lukyanov D.A., Sergiev P.V., Dontsova O.A., Korshun V.A., Li F.N. & Sun C.H. (2018). Diversity, novelty, and antimicrobial activity of endophytic actinobacteria from mangrove plants in Beilun Estuary National Nature Reserve of Guangxi, China. Frontiers in Microbiology, 9. doi: 10.3389/fmicb.2018.00868.
Kakinuma, S., Susuki H., Hatori M., Saitoh K., Hasegawa T., Furumai T. & Oki T. (1993). Biosynthesis of the pradimicin family of antibiotics. III. Biosynthetic pathway of both pradimicins and benanomicins. The Journal of Antibiotics, 46(3), 430–440. doi: 10.7164/antibiotics.46.430.
Kataoka, M., Ueda K., Kudo T., Seki T. & Yoshida T. (1997). Application of the variable region in 16S rDNA to create an index for rapid species identification in the genus Streptomyces. FEMS Microbiology Letters, 151(2), 249–255. doi: 10.1111/j.1574-6968.1997.tb12578.x.
Kodani, S., Komaki H., Ishimura S., Hemmi H. & Ohnishi-Kameyama M. (2016). Isolation and structure determination of a new lantibiotic cinnamycin B from Actinomadura atramentaria based on genome mining. Journal of Industrial Microbiology and Biotechnology, 43(8), 1159–1165. doi: 10.1007/s10295-016-1788-9.
Koehn, F.E. & Carter G.T. (2005). The evolving role of natural products in drug discovery. Nature Reviews Drug Discovery, 4(3), 206–220. doi: 10.1038/nrd1657.
Küster, E. & Williams S.T. (1964). Selection of media for isolation of streptomycetes. Nature, 202, 928–929. doi: 10.1038/202928a0.
Matsumoto, A. & Takahashi Y. (2017). Endophytic actinomycetes: promising source of novel bioactive compounds. The Journal of Antibiotics, 70(5), 514–519. doi: 10.1038/ja.2017.20.
Mesta, S.C., Rudrappa O., Meghana S.H., Manu H.M., Kavana S. & Talib M. (2018). Phosphate solubilizing endophytic actinomycetes from mangrove plants Rhizophora mucronata and Sonneratia caseolaris and its effect on Seedling vigour. Research Journal of Pharmacy and Technology, 11(3), 1172–1178. doi:10.5958/0974-360X.2018.00219.6.
Mancuso, G., Midiri, A., Gerace, E., & Biondo, C. (2021). Bacterial Antibiotic Resistance: The Most Critical Pathogens. Pathogens, 10(10), 1310. doi: 10.3390/pathogens10101310.
Mingma, R., Pathom-aree W., Trakulnaleamsai S., Thamchaipenet A. & Duangmal K. (2014). Isolation of rhizospheric and roots endophytic-actinomycetes from Leguminosae plant and their activities to inhibit soybean pathogen, Xanthomonas campestris pv. glycine. World Journal of Microbiology and Biotechnology, 30(1), 271–280. doi: 10.1007/s11274-013-1451-9.
Nakamura, G. & Isono E.K. (1983). A new species of Actinomadura producing
a polyether antibiotic, cationomycin. The Journal of Antibiotics, 36(11), 1468–1472. doi: 10.7164/antibiotics.36.
1468.
Neut, D., Hendriks J.G.E., van Horn J.R., van der Mei H.C. & Busscher H.J. (2005). Pseudomonas aeruginosa biofilm formation and slime excretion on antibiotic-loaded bone cement. Acta Orthopaedica, 76(1), 109–114.
doi: 10.1080/00016470510030427.
Nikaido, H. (1989). Outer membrane barrier
as a mechanism of antimicrobial resistance. Antimicrobial Agents and Chemotherapy, 33(11), 1831–1836. doi: 10.1128/aac.33.11.1831.
Niyomvong, N., Pathom-Aree W., Thamchaipenet A. & Duangmal K. (2012). Actinomycetes from tropical limestone caves. Chiang Mai Journal of Science, 39(3), 373–388.
Quach, N.T., Vu T.H.N., Bui T.L., Le T.T.X., Nguyen T.T.A., Ngo C.C. & Phi Q.T. (2022). Genomic and physiological traits provide insights into ecological niche adaptations of mangrove endophytic Streptomyces parvulus VCCM 22513. Annals of Microbiology, 72(27), doi: 10.1186/s13213-022-01684-6.
Rachniyom, H., Matsumoto A., Indananda C., Duangmal K., Takahashi Y. & Thamchaipenet A. (2015). Actinomadura syzygii sp. nov., an endophytic actinomycete isolated from the roots of a jambolan plum tree (Syzygium cumini L. Skeels). International Journal of Systematic and Evolutionary Microbiology, 65(6), 1946–1949. doi: 10.1099/ijs.0.000203.
Rachniyom, H., Matsumoto A., Inahashi Y., Take A., Takahashi Y. & Thamchaipenet A. (2018). Actinomadura barringtoniae sp. nov., an endophytic actinomycete isolated from the roots of Barringtonia acutangula (L.) Gaertn. International Journal of Systematic and Evolutionary Microbiology, 68(5), 1584–1590. doi: 10.1099/ijsem.0.002714.
Ravikumar, S., Ibaneson S.J., Uthiraselvam M., Priya S.R., Ramu A. & Banerjee M.B. (2011). Diversity of endophytic actinomycetes from Karangkadu mangrove ecosystem and its antibacterial potential against bacterial pathogens. Journal of Pharmacy Research, 4(1), 294–296.
Rosenfeld, Y. & Shai Y. (2006). Lipopolysaccharide (Endotoxin)-host defense antibacterial peptides interactions: Role in bacterial resistance and prevention of sepsis. Biochimica et Biophysica Acta (BBA) – Biomembranes, 1758(9), 1513–1522. doi: 10.1016/j.bbamem.2006.05.017.
Sapkota, A., Thapa A., Budhathoki A., Sainju M., Shrestha P. & Aryal S. (2020). Isolation, characterization, and screening of antimicrobial-producing actinomycetes from soil samples. International Journal of Microbiology, 2020, doi: 10.1155/2020/27o16584.
Shirling, E.B. & Gottlieb D. (1966). Methods for characterization of Streptomyces species1. International Journal of Systematic and Evolutionary Microbiology, 16(3), 313–340. doi: 10.1099/00207713-16-3-313.
Suksaard, P., Pathom-aree W. & Duangmal K. (2017). Diversity and plant growth promoting activities of actinomycetes from mangroves. Chiang Mai Journal of Science, 44, 1210–1223.
Také, A., Matsumoto A., Omura S. & Takahashi Y. (2015). Streptomyces lactacystinicus sp. nov. and Streptomyces cyslabdanicus sp. nov., producing lactacystin and cyslabdan, respectively. The Journal of Antibiotics, 68(5),
322–327. doi: 10.1038/ja.2014.162.
Tung, Q.N., Lien B.T., Nguyen V.T.H., An N.T.T., Ha C.H. & Tien P.Q. (2002). Endophytic actinomycetes from mangrove plant Avicennia marina in Quang Ninh Province, Vietnam: Distribution, cytotoxicity, and antioxidant activities. Academia Journal of Biology, 44(3), 87–98. doi: 10.15625/2615-9023/17492.
Ventura, M., Canchaya C., Tauch A., Chandra G., Fitzgerald G.F., Chater K.F. & van Sinderen D. (2007). Genomics of Actinobacteria: tracing the evolutionary history of an ancient phylum. Microbiology and Molecular Biology Reviews, 71(3), 495–548. doi: 10.1128/MMBR.00005-07.
Whitman, W.B., Goodfellow M., Kämpfer P., Busse H.-J., Trujillo M.E., Ludwig W., Suzuki K.-i. & Parte A. (2012). Bergey's Manual of Systematic Bacteriology: Volume 5 The Actinobacteria (2nd ed). New York: Springer.
Xu, D.B., Ye W.W., Han Y., Deng Z.X. & Hong K. (2014). Natural products from mangrove actinomycetes. Marine drugs, 12(5), 2590–2613. doi: 10.3390/md12052590.
Yoon, S.H., Ha S.M., Kwon S., Lim J., Kim Y., Seo H. & Chun J. (2017). Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies. International Journal of Systematic and Evolutionary Microbiology, 67(5), 1613–1617. doi: 10.1099/ijsem.0.001755.